一种强化多氯联苯微生物厌氧脱氯的方法
阅读说明:本技术 一种强化多氯联苯微生物厌氧脱氯的方法 (Method for strengthening anaerobic dechlorination of polychlorinated biphenyl microorganisms ) 是由 张冬冬 李新凯 陈友华 章春芳 郑刚 肖金星 于 2021-08-20 设计创作,主要内容包括:本发明提供了一种强化多氯联苯微生物厌氧脱氯的方法,属于电化学技术领域,本发明将负电能极化的电化学石墨电极(-0.3~-0.5V vs.SHE)与PCBs脱氯菌结合,进行高氯代多氯联苯脱氯,能够显著促进高氯代商业多氯联苯混合物的微生物脱氯速率(从8.6μM·Cl~(-)·d~(-1)提高到11.6μM·Cl~(-)·d~(-1)),相比于开路系统(23.7%~25.1%),电能系统中拥有更高比例的(43.2%~46.6%)四氯代多氯联苯作为脱氯产物。(The invention provides a method for strengthening microorganism anaerobic dechlorination of polychlorinated biphenyl, which belongs to the technical field of electrochemistry, combines an electrochemical graphite electrode (minus 0.3 to minus 0.5V vs. SHE) polarized by negative electric energy with PCBs dechlorination bacteria to dechlorinate the polychlorinated biphenyl, and can remarkably promote the microorganism dechlorination rate (from 8.6 mu M. Cl.) of a high-chlorinated commercial polychlorinated biphenyl mixture ‑ ·d ‑1 Increased to 11.6. mu.M. Cl ‑ ·d ‑1 ) Compared to open-circuit systems (23.7% to 25.1%), electrical energy systems have a higher proportion (43.2% to 46.6%) of tetrachloropolychlorinated biphenyls as dechlorinated products.)
技术领域
本发明涉及电化学技术领域,尤其涉及一种强化多氯联苯微生物厌氧脱氯的方法。
背景技术
多氯联苯(polychlorinated biphenyls,PCBs)是最具有代表性的一类持久性有机污染物(persistent organic pollutants,POPs),也属于环境荷尔蒙(Environmentalhormones)、环境激素或内分泌干扰物(Endocrine disrupters),2001年5月被列入联合国环境规划署12种POPs之列。多氯联苯属于致癌物质,具有疏水性,容易累积在脂肪组织,造成脑部、皮肤及内脏的疾病,并影响神经、生殖及免疫系统。
高氯代PCBs(至少五氯代)由于其氯代程度高,相比低氯代PCBs具有更强的毒性,通过各种方法对其进行脱氯,则毒性大为减小。目前,PCBs脱氯减毒的主要方法包括:零价金属还原脱氯、辐射降解脱氯、微生物还原脱氯和化学催化脱氯。其中,微生物对PCBs的脱氯作用具有绿色、环境友好等特性,并且普遍存在于厌氧沉积物环境中。
微生物厌氧还原代谢减少了高氯代PCBs氯取代的数量和位点,降低了PCBs的毒性并使之更易被好氧微生物利用进行矿化降解,厌氧还原脱氯是高氯代PCBs进行生物降解的先决条件。高氯代PCBs经过微生物的厌氧脱氯降解,从两方面降低了其环境毒性:一是从高氯转化为低氯代PCBs,可进一步被好氧菌代谢彻底降解;二是脱氯过程把高氯同系物转化为不易被富集到食物链的低氯联苯,降低了生物富集力。Chen等报道,通过更替调控水稻田厌氧-好氧环境,结合微生物厌氧-好氧代谢过程,从而达到对水稻田环境中40%以上总PCBs污染的修复,尤其是针对高氯代PCBs的减少(Chen C,Yu C,Shen C,et al.Paddyfield–A natural sequential anaerobic–aerobic bioreactor for polychlorinatedbiphenyls transformation[J].Environmental Pollution,2014,190:43-50)。但是,微生物还原脱氯缓慢,往往需要数月甚至更久。
发明内容
本发明的目的在于提供一种强化多氯联苯微生物厌氧脱氯的方法,本发明的方法具有高的脱氯速率。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了一种强化多氯联苯微生物厌氧脱氯的方法,包括以下步骤:
1)将石墨电极和Ag/AgCl饱和电极置于阴极室内,将铂丝电极置于阳极室内,所述阴极室和所述阳极室通过质子交换膜进行分隔;
所述阴极室和所述阳极室内放置有厌氧培养基;
所述阴极室的厌氧培养基中还含有待处理高氯代多氯联苯和低电势的有机碳源,所述低电势的有机碳源包括乳酸、甲酸、乙酸和葡萄糖中的一种或几种;所述阴极室的厌氧培养基中还接种有PCBs脱氯菌;
2)在石墨电极上施加-0.3~-0.5V的电势,进行脱氯反应;
所述高氯代多氯联苯为至少五氯代多氯联苯。
优选的,所述PCBs脱氯菌包括以下组分:脱卤拟球菌(Dehalococcoides)、脱硫弧菌(Desulfovibrio)、脱硫杆菌(Desulfitobacterium)和甲烷八叠球菌(Methanosarcina)。
优选的,所述脱卤拟球菌(Dehalococcoides)、脱硫弧菌(Desulfovibrio)、脱硫杆菌(Desulfitobacterium)和甲烷八叠球菌(Methanosarcina)的有效活菌数的比例为(2~4):(1~2):(4~5):(1~2);所述PCBs脱氯菌的总有效活菌数为(5~6)×107cfu/mL。
优选的,所述待处理高氯代多氯联苯包括多氯联苯商业混合物Aroclor 1260。
优选的,所述阴极室的厌氧培养基中含有的高氯代多氯联苯的起始浓度为20~30mg/mL。
优选的,所述阴极室的厌氧培养基中含有的低电势的有机碳源的起始浓度为8~10mM。
优选的,所述厌氧培养基中还包括固态腐殖质;所述固态腐殖质在厌氧培养基中的浓度为6~7g/L。
优选的,所述脱氯包括第一脱氯;所述第一脱氯的时间为30~35d。
优选的,所述脱氯还包括第二脱氯;所述第二脱氯的步骤包括:在所述第一脱氯后,在所述阴极室的厌氧培养基中补加高氯代多氯联苯至高氯代多氯联苯的浓度为20~30mg/mL进行第二脱氯;
所述第二脱氯的时间为7~12d。
优选的,所述脱氯还包括第三脱氯;所述第三脱氯的步骤包括:在所述第二脱氯后,将所述阴极室内的悬浮培养物排出,在阴极室内加入改良厌氧培养基和高氯代多氯联苯,采用阴极形成的生物膜对高氯代多氯联苯进行第三脱氯;所述第三脱氯的时间为8~15d;所述高氯代多氯联苯的初始浓度为20~30mg/mL;
所述改良厌氧培养基以厌氧培养基为基础,还含有低电势的有机碳源;所述改良厌氧培养基中低电势的有机碳源的摩尔浓度为1~3mM。
本发明提供了一种强化多氯联苯微生物厌氧脱氯的方法,本发明将石墨电极和Ag/AgCl饱和电极置于阴极室内,将铂丝电极置于阳极室内,所述阴极室和所述阳极室通过质子交换膜进行分隔;所述阴极室和所述阳极室内分别加入有厌氧培养基;所述阴极室的厌氧培养基中加入有高氯代多氯联苯和低电势的有机碳源;所述阴极室的厌氧培养基中还接种有PCBs脱氯菌;采用电化学工作站连接所述石墨电极、所述Ag/AgCl饱和电极和所述铂丝电极构成双室三电极系统,在石墨电极上施加-0.3~-0.5V的电势,进行脱氯反应。本发明将负电能极化的电化学石墨电极(-0.3~-0.5V vs.SHE)与PCBs脱氯菌结合,进行高氯代多氯联苯脱氯,能够显著促进高氯代多氯联苯的微生物脱氯速率(从8.6μM·Cl-·d-1提高到11.6μM·Cl-·d-1),相比于开路系统(23.7%~25.1%),电能系统中拥有更高比例的(43.2%~46.6%)四氯代多氯联苯作为脱氯产物。
附图说明
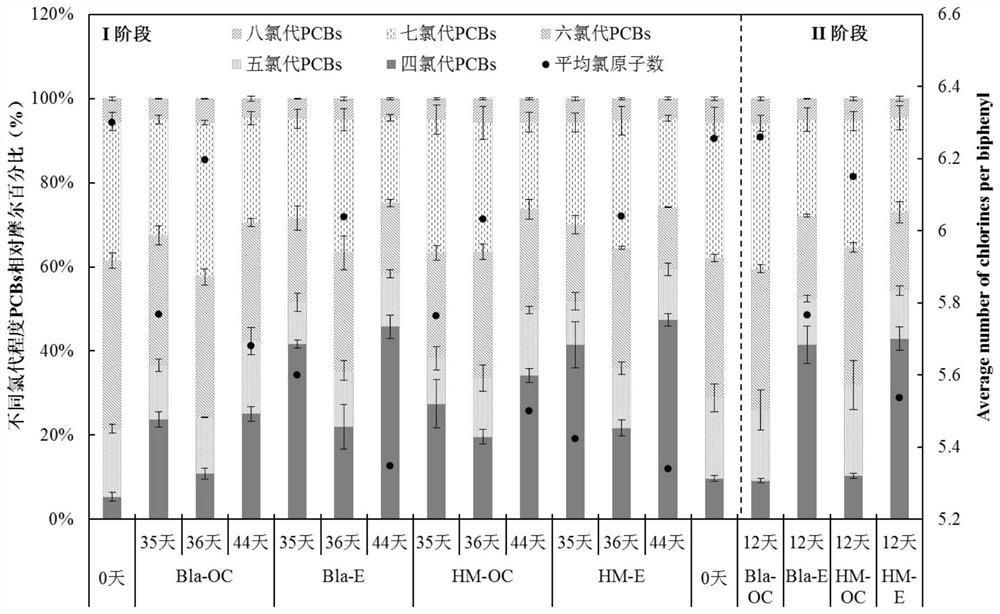
图1为I阶段和II阶段不同氯代程度PCBs摩尔百分比的变化,其中,I阶段为第一脱氯和第二脱氯;II阶段为第三脱氯(以改良厌氧培养基更换阴极室悬浮培养物);Bla-OC:不添加腐殖质的开路系统;Bla-E:不添加腐殖质的通电系统;HM-OC:添加腐殖质的开路系统;HM-E:添加腐殖质的通电系统;在36d,再次添加25mg/L Aroclor 1260到各培养系统中;
图2为培养系统中各PCB同系物摩尔百分比的绝对变化量(与第0天相比),正负值分别表示PCBs的产生和脱氯;其中,Bla-OC:不添加腐殖质的开路系统;Bla-E:不添加腐殖质的通电系统;HM-OC:添加腐殖质的开路系统;HM-E:添加腐殖质的通电系统。
具体实施方式
本发明提供了一种强化多氯联苯微生物厌氧脱氯的方法,包括以下步骤:
1)将石墨电极和Ag/AgCl饱和电极置于阴极室内,将铂丝电极置于阳极室内,所述阴极室和所述阳极室通过质子交换膜进行分隔;
所述阴极室和所述阳极室内放置有厌氧培养基;
所述阴极室的厌氧培养基中还含有待处理高氯代多氯联苯和低电势的有机碳源,所述低电势的有机碳源包括乳酸、甲酸、乙酸和葡萄糖中的一种或几种;所述阴极室的厌氧培养基中还接种有PCBs脱氯菌;
2)在石墨电极上施加-0.3~-0.5V的电势,进行脱氯反应;
所述高氯代多氯联苯为至少五氯代多氯联苯。
本发明首先将石墨电极和Ag/AgCl饱和电极置于阴极室内,将铂丝电极置于阳极室内,所述阴极室和所述阳极室通过质子交换膜进行分隔;所述阴极室和所述阳极室内分别加入有厌氧培养基;所述阴极室的厌氧培养基中还含有待处理高氯代多氯联苯和低电势的有机碳源,所述低电势的有机碳源包括乳酸、甲酸、乙酸和葡萄糖中的一种或几种;所述阴极室的厌氧培养基中还接种有PCBs脱氯菌。
本发明的方法优选的采用双室的生物电化学系统(BES)进行;所述BES由两个150mL的聚四氟乙烯材质瓶子构成。
在本发明中,BES的组装、采样和培养基的更换优选的在手套箱中进行以保持电极室内的厌氧环境;所述BES优选的在30℃的生化培养箱中培养。
在本发明中,所述石墨电极的直径优选为6mm;所述石墨电极的有效表面积优选为6.48cm2;所述石墨电极作为工作电极;所述Ag/AgCl饱和电极电势相对于标准氢电极为+199mV;所述Ag/AgCl饱和电极作为参比电极;所述铂电极优选为螺旋状铂丝;所述铂丝电极的规格优选为0.8mm×0.5m;所述铂丝电极作为对电极。
在本发明中,所述质子交换膜优选为Nafion 117,Dupont,Wilmington,DE,USA;所述质子交换膜只允许质子自由通过,能够保持两个隔室的相对中性环境。
在本发明中,所述阴极室和所述阳极室内的厌氧培养基的加入量占总容积的4/5。
在本发明中,对所述厌氧培养基的配方没有特殊限制,采用本领域常规配方即可。在本发明中,所述阴极室的厌氧培养基中含有的高氯代多氯联苯的起始浓度优选为20~30mg/mL,更优选为25mg/mL。在本发明中,所述阴极室的厌氧培养基中含有的低电势的有机碳源的起始浓度优选为8~10mM,更优选为9mM。
在本发明具体实施过程中,所述厌氧培养基以1L计,包括以下组分:NH4Cl 0.7~0.8g、CaCl2·2H2O 0.01~0.02g、MgCl2·6H2O 0.4~0.5g、K2HPO4 0.15~0.25g、NaCl 0.8~1.2g、KCl 0.25~0.35g、Trace element SL-10溶液0.8~1.2mL、Se/W溶液0.8~1.2mL、维生素溶液0.8~1.2mL和MOPS 12~18mM;所述MOPS的pH值为7.0~7.2;具体如表1所示。
表1厌氧培养基组分(升-1)
注:MOPS为3-(N-吗啉基)丙磺酸。
在本发明中,维生素溶液的配方参见(Holliger et al.,1998);Trace elementSL-10溶液的配方和Se/W溶液的配方参见(Widdel et al.,1983)。
参考文献:
Holliger,C.,Hahn,D.,Harmsen,H.,Ludwig,W.,Schumacher,W.,Tindall,B.,Vazquez,F.,Weiss,N.,Zehnder,A.J.B.,1998.Dehalobacter restrictus gen.nov.andsp.nov.,a strictly anaerobic bacterium that reductively dechlorinates tetra-and trichloroethene in an anaerobic respiration.Arch.Microbiol.169,313–321.
Widdel,F.,Kohring,G.W.,Mayer,F.,1983.Studies on dissimilatorysulfate-reducing bacteria that decompose fatty acids.III.Characterization ofthe filamentous gliding Desulfonema limicola gen.nov.sp.nov.and Desulfonemamagnum sp.nov.Arch.Microbiol.134,286–294.
在本发明中,所述厌氧培养基中优选的还包括固态腐殖质;所述固态腐殖质的浓度优选为6~7g/L,更优选为6.7g/L;所述固态腐殖质作为电子媒介体进一步强化了电化学系统对PCBs的脱氯速率。
在本发明中,所述乳酸作为PCBs脱氯菌生长的碳源和还原脱氯代谢的电子供体。
在本发明中,所述PCBs脱氯菌包括以下组分:脱卤拟球菌(Dehalococcoides)、脱硫弧菌(Desulfovibrio)、脱硫杆菌(Desulfitobacterium)和甲烷八叠球菌(Methanosarcina)。在本发明中,所述脱卤拟球菌(Dehalococcoides)、脱硫弧菌(Desulfovibrio)、脱硫杆菌(Desulfitobacterium)和甲烷八叠球菌(Methanosarcina)的有效活菌数的比例优选为(2~4):(1~2):(4~5):(1~2),更优选为3:1.5:4.5:1.5;所述PCBs脱氯菌的总有效活菌数优选为(5~6)×107cfu/mL。
在本发明中,所述脱卤拟球菌(Dehalococcoides)、脱硫弧菌(Desulfovibrio)、脱硫杆菌(Desulfitobacterium)和甲烷八叠球菌(Methanosarcina)来源于常规市售,优选的购自于德国微生物菌种保藏中心(DSMZ)。
在本发明中,Dehalococcoides作为专性脱氯菌,其对PCBs(包括商业PCBs混合物Aroclors)还原脱氯能力已进行了广泛的报道,为最主要的PCBs脱氯功能菌。Desulfitobacterium作为兼性脱氯菌,其对氯乙烯和氯酚具有脱氯能力,有报道可能参与PCBs还原脱氯代谢。Desulfovibrio和Methanosarcina作为发酵微生物,通过提供电子供体和碳源从而辅助Dehalococcoides完成PCBs还原脱氯代谢。阴极生物膜表面的Desulfovibrio和Methanosarcina菌的占比较少,由于Dehalococcoides脱氯代谢逐渐适应利用电极作为电子供体,不需要Desulfovibrio和Methanosarcina再进行提供。
在本发明中,所述高氯代多氯联苯优选的包括Aroclor 1260;所述Aroclor 1260为商业PCBs混合物。在本发明中,所述高氯代多氯联苯优选的先溶于丙酮再加入到厌氧培养基中。
在本发明中,Aroclor 1260被广泛应用于电力设备绝缘介质等工业产品中。具有高毒性、疏水性、环境持久性与长距离迁移特性,并且能在生物体内富集和通过食物链逐级放大,严重威胁着人类健康与生态安全,广泛分布于环境当中,难以降解。
在本发明中,所述厌氧培养基中高氯代多氯联苯的起始浓度优选为20~30mg/mL,更优选为25mg/mL。
本发明采用电化学工作站连接所述石墨电极、所述Ag/AgCl饱和电极和所述铂丝电极构成双室三电极系统,在石墨电极上施加-0.3~-0.5V的电势,进行脱氯反应。
在本发明中,所述-0.3~-0.5V的电势是相对于标准氢电极的电势。
在本发明中,所述脱氯包括第一脱氯;所述第一脱氯的时间优选为30~35d,更优选为32d;所述脱氯的温度优选为20~35℃,更优选为25~30℃。在本发明中,所述第一脱氯的时间以低氯代PCBs不再累积为准;所述低氯代PCBs为氯原子个数<5个的多氯联苯。在本发明具体实施过程中,通过气相色谱质谱联用仪(GC-MS)对培养体系进行测定,每五天测定一次,低氯代PCBs没有更多的累积则认为脱氯反应停止。
在本发明中,所述脱氯优选的还包括第二脱氯;所述第一脱氯后,在所述阴极室的厌氧培养基中补加高氯代多氯联苯至高氯代多氯联苯的浓度为20~30mg/mL进行第二脱氯;补加的高氯代多氯联苯的初始浓度优选为25mg/mL;所述第二脱氯的时间优选为7~12d,更优选为8~10d。
在本发明中,PCBs脱氯菌逐渐适应利用电极作为电子供体,并通过在阴极表面形成生物膜可以更为高效的利用阴极提供的电子作用于还原脱氯代谢;同时,阴极使用石墨电极,具有较高的生物相容性,微生物比较容易在其表面生长形成生物膜。在本发明中,所述第一脱氯和第二脱氯过程中,逐渐在阴极表面形成了阴极生物膜,阴极生物膜上的PCBs脱氯菌和厌氧培养基中的悬浮PCBs脱氯菌共同代谢高氯代PCBs。
在本发明中,所述第一脱氯和第二脱氯过程中,脱氯菌逐渐适应利BES阴极作为微生物脱氯代谢的电子供体。
在本发明中,所述脱氯优选的还包括第三脱氯;所述第二脱氯后,将所述阴极室内的悬浮培养物排出,在阴极室内加入改良厌氧培养基和高氯代多氯联苯,以除去阴极室内悬浮培养物中的微生物,仅保留阴极生物膜作用于微生物还原脱氯;所述高氯代多氯联苯的初始浓度优选为20~30mg/mL,更优选为25mg/mL;所述第三脱氯的时间优选为8~15d,更优选为9~12d;所述改良厌氧培养基以厌氧培养基为基础,还含有低电势的有机碳源;所述改良厌氧培养基中低电势的有机碳源的摩尔浓度优选为1~3mM,更优选为2mM。在本发明中,所述第三脱氯过程中,仅阴极生物膜上的PCBs脱氯菌代谢高氯代PCBs。在本发明中,PCBs脱氯菌逐渐适应利用阴极作为电子供体,通过将厌氧培养基中的乳酸浓度降低至1~3mM,既保证PCBs脱氯菌的生长代谢,同时促使PCBs脱氯菌利用阴极作为电子供体。
本发明仅仅依靠阴极生物膜上的PCBs脱氯菌就可以继续维持系统的微生物厌氧脱氯活性。施加电能明显影响到阴极生物膜微生物群落结构组成,阴极生物膜上相比于悬浮培养物含有更高比例的脱氯功能菌Dehalococcoides。而且,附着于阴极表面的Dehalococcoides具有更高的脱氯速率。
下面将结合本发明中的实施例,对本发明中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本实施例中,BES的组装、采样和培养基的更换均在手套箱(AW300SG,Electrotek,Leeds,UK)中进行以保持电极室内的厌氧环境;所述BES在30℃的生化培养箱中培养;除非另有说明,本研究所说的电势均为相对于标准氢电极。
实施例1
1、复配PCBs脱氯菌;所述PCBs脱氯菌由以下有效活菌份数的组分组成:脱卤拟球菌(Dehalococcoides mccartyi)3份、脱硫弧菌(Desulfovibrio desulfuricans)1份、脱硫杆菌(Desulfitobacterium dehalogenans)5份和甲烷八叠球菌(Methanosarcinabarkeri)1份,总有效活菌数为(5~6)×107cfu/mL,购自于德国微生物菌种保藏中心(DSMZ)。
2、构建双室BES。BES由两个150mL的聚四氟乙烯材质瓶子构成,中间由质子交换膜(Nafion 117,Dupont,Wilmington,DE,USA)进行分隔。使用多通道恒电位仪施加稳定电势;
其中,BES使用石墨电极(6mm;有效表面积为6.48cm2)作为工作电极,饱和Ag/AgCl(+199mV,相对于标准氢电极)作为参比电极,使用螺旋状铂丝(0.8mm×0.5m)作为对电极;
所述工作电极和参比电极放置在阴极室,对电极放置在阳极室;
3、将5mg的Aroclor1260溶于2mL的丙酮溶液中,配置成为浓度为25g/L的储备液,之后加30μL的Aroclor 1260储备液到30mL的加入有乳酸的厌氧培养基(参见表2)中,配置成Aroclor1260终浓度为25mg/L的培养体系;
表2实施例1采用的厌氧培养基组分(升-1)
第一脱氯:阳极室和阴极室各加入110mL的厌氧培养基,在阴极室中加入Aroclor1260终浓度为25mg/L,并接种10mL步骤1)的PCBs脱氯菌,在阴极上施加-0.35V电势(相对于标准氢电极)。通过GC-MS对阴极室培养体系进行测定,每五天测定一次,培养35天后,四氯代PCBs作为终产物没有更多的累积则认为脱氯反应停止。
利用GC-MS测定阴极室的厌氧培养基中高氯代(氯原子个数≥5)和低氯代(氯原子个数≤4)PCBs含量,结果见图1;图1结果显示,BES第一脱氯(I阶段35天)最大脱氯速率达到11.6μM·Cl-·d-1,35天后脱氯产物四氯代PCBs占到总PCBs的摩尔百分比为43.2%,生成较多的四氯代PCBs脱氯产物。
第二脱氯:第36天,在阴极室的厌氧培养基中补加Aroclor 1260丙酮溶液至Aroclor 1260的终浓度为25mg/L,继续通电培养至第44天(培养8天后),测定其中高氯代和低氯代PCBs的含量,结果见图1和图2(I阶段44天)。44天后脱氯产物四氯代PCBs占到总PCBs的摩尔百分比为46.6%;
图1显示各个培养系统中微生物还原脱氯代谢活性,可以看出,生物电化学方法显著提高了高氯代多氯联苯的脱氯速率,产生了更高摩尔比的四氯代多氯联苯终产物;由图2可以看出四氯代多氯联苯PCB47,PCB49,PCB51,PCB52,PCB53作为主要脱氯代谢终产物,电能的存在并没有对培养体系脱氯程度和途径产生明显的影响。通过依次进行第一脱氯和第二脱氯,能够看出,本申请的脱氯方法具有长效性。
4、第三脱氯:采用改良厌氧培养基更换阴极室厌氧培养基(改良厌氧培养基除将乳酸浓度更换为3mM以外,其余成分与表2保持相同)以除去悬浮培养物中的微生物,电极电位与之前保持一致,利用前期反应于工作电极上形成的生物膜代谢Aroclor 1260(初始浓度和I阶段一样,为25mg/mL)中的高氯代PCBs,12天后,利用GC-MS测定高氯代和低氯代PCBs含量(Ⅱ阶段);
通过第三脱氯可以看出,本发明仅仅依靠阴极生物膜上的PCBs脱氯菌就可以继续维持系统的厌氧脱氯活性,再次证明了本申请的脱氯方法的稳定性和长效性。
5、微生物群落分析:对I阶段(第一脱氯和第二脱氯)结束时的阴极室内的悬浮培养物和Ⅱ阶段(第三脱氯)结束时的阴极生物膜进行取样,测定其菌群组成及含量,对比出电能导致的脱氯培养物菌群的变化情况,测定过程具体如下所示:
从同一种处理的三个平行样中各取1mL的悬浮培养物并合并,用于DNA的提取。将阴极生物膜从电极上刮下,然后用无菌的厌氧培养基冲洗,用于DNA的提取。使用E.Z.N.AMag-Bind Soil DNA Kit试剂盒(Omega Bio-Tek,Norcross,GA,USA)并按照试剂盒说明书进行微生物DNA的提取。使用实时荧光定量PCR仪(LightCycler 480Ⅱ,Roche,Mannheim,Germany)对培养体系中的总菌、PCBs厌氧脱氯功能菌及其功能基因进行定量分析。使用特异性引物对脱氯菌群中脱卤拟球菌(Dehalococcoides mccartyi)及其PCBs脱氯功能基因pcbA1、pcbA4和pcbA5进行定量分析。
5、结果如下:脱卤拟球菌(Dehalococcoides mccartyi)的菌体数百分比在通电情况下阴极生物膜表面可以达到60%~80%,而其他菌的百分比相对较低,可以看出,施加电能对阴极生物膜微生物群落结构组成产生明显的影响,电能对脱卤拟球菌(Dehalococcoides mccartyi)表现出选择性富集,相比于悬浮培养物中(20%~30%),更高比例的脱氯功能菌Dehalococcoides存在于阴极生物膜表面,这可能是导致BES对高氯代PCBs具有高脱氯效率的主要原因。
实施例2
参见实施例1的方法进行脱氯,与实施例1不同的是,厌氧培养基中还加入有6.7g/L的固态腐殖质,利用GC-MS测定阴极室的厌氧培养基中高氯代(氯原子个数≥5)和低氯代(氯原子个数≤4)PCBs含量,结果显示:脱氯速率为14.1μM·Cl-·d-1。可以看出,固态腐殖质的引入强化了电化学系统对PCBs的脱氯速率。
对比例1
参见实施例1的方法进行脱氯,与实施例1不同的是,不在阴极上施加电势(开路系统),利用GC-MS测定阴极室的厌氧培养基中高氯代(氯原子个数≥5)和低氯代(氯原子个数≤4)PCBs含量,结果显示:脱氯速率为8.6μM Cl-·d-1,35天后脱氯产物四氯代PCBs占总PCBs的23.7%,44天(第二脱氯)后脱氯产物四氯代PCBs占到总PCBs的摩尔百分比为25.1%。
由实施例1和对比例1比较可以看出,通电后,厌氧脱氯菌对商业多氯联苯混合物Aroclor1260的脱氯速度得到强化,脱氯更彻底。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 上一篇:一种医用注射器针头装配设备
- 下一篇:一种环保的污水处理装置
